Toutes les solutions qui ne contiennent pas d’ions sont isolantes.
L’eau pure, par définition, n’a été mélangée à aucun autre composé et ne devrait donc contenir aucun ion. Cependant il se produit une transformation chimique au sein des molécules d’eau qui conduit à la formation d’ions hydrogène et d’ions hydroxyde.
Même une eau pure peut donc conduire le courant électrique.
Pour qu’un liquide soit conducteur il doit contenir des ions. Une solution aqueuse est donc conductrice si un solide y a été dissout.
L’eau salée est par exemple conductrice car elle contient des ions chlorure et de ions sodium.
L’eau du robinet ainsi que les eaux de source et les eaux minérales sont aussi conductrices car elles contiennent des proportions plus ou moins élevées de minéraux qui sont sous forme d’ions (ion magnésium, ion sodium, ion calcium, ion potassium etc.).
Dans une solution aqueuse un courant électrique se traduit par le déplacement des cations vers la borne négative tandis que les anions se dirigent vers la borne positive.
Par définition la corrosion d’un matériau correspond à sa dégradation.
Elle peut avoir des causes mécaniques comme des frottements ou des causes chimiques.
A l’air libre, les métaux sont en présence de dioxygène, d’eau, de dioxyde de carbone et de gaz polluants qui peuvent provoquer une transformation chimique dont le métal est l’un des réactifs. Ce dernier est alors consommé tandis que se forment le ou les produits de corrosion.
La corrosion des métaux et de leurs alliages témoigne de leur tendance à revenir à leur état original de minerais (oxydes, sulfures, carbonates, …) sous l’action des agents atmosphériques.
La calamine : corrosion de l’acier
Composition de la calamine
Oxydes complexes du fer de couleur bleutée : Fe O, Fe3O4, Fe2O3, qui apparaissent à la surface de l’acier lors du laminage, la calamine peut être plus ou moins souillée par les produits utilisés lors de la transformation ou du façonnage du métal
Corrosion généralisée ou uniforme
La corrosion uniforme ou généralisée se manifeste avec la même vitesse en tous les points du métal entraînant une diminution régulière de l’épaisseur de celui-ci.
Différentes formes de corrosion localisées
Corrosion par piqûres
Corrosion localisée en un ou plusieurs points avec pénétration dans la masse du métal pouvant aboutir à une perforation .Cette forme de corrosion peut évoluer vers une corrosion par aération différentielle
Corrosion intergranulaire
C’est une attaque sélective par suite d’hétérogénéités locales à l’interface du métal : appauvrissement de l’un des constituants ou au contraire, enrichissement par suite de précipitation lors d’un traitement thermique par exemple.
Corrosion par aération différentielle
Appelée aussi corrosion caverneuse, elle est due à une différence de concentration de l’oxygène entre deux zones d’une structure métallique ou d’un assemblage.
Corrosion galvanique
Il s’agit de l’attaque préférentielle de la phase la moins noble d’un alliage comportant deux phases ou de la corrosion pouvant exister entre au moins deux matériaux métalliques en contact placés dans le même environnement.
Corrosion- Érosion
C’est la détérioration (usure) qui se produit à l’interface entre des surfaces en contact
Corrosion sous contrainte et fatigue-corrosion
C’est une fissuration du métal qui résulte de l’action commune d’une contrainte mécanique et d’une réaction électrochimique.
La Corrosion par piqûres est généralement l’amorce d’une corrosion par aération différentielle et s’applique en particulier aux aciers dits inoxydables.
Anode = électrode où se produit la réaction d’oxydation (dissolution du métal), où le courant passe du métal vers la solution (*électrolyte).
Cathode = électrode où se produit la réaction de réduction (déposition à la surface du métal), où le courant passe de la solution (*électrolyte) vers le métal.
*Électrolyte = Substance ou composé qui, à l’état liquide ou en solution, permet le passage du courant électrique par déplacement d’ions.
Le potentiel de corrosion est le potentiel que prend un métal ou un alliage métallique donné par rapport un électrolyte donné. Il est dépendant des conditions environnementales et peut être mesurée par rapport à une électrode de référence.
L’électrode de référence a un potentiel choisi comme référence initiale de potentiel.
Une des plus utilisées en laboratoire est l’électrode au calomel saturé. Sur site onshore on utilisera de préférence une électrode de Cuivre /sulfate de cuivre et en offshore une électrode Argent/ Chlorure d’Argent. D’autres possibilités existent mais réservées à des spécialistes.
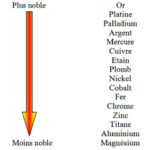
Il est établi une classification des métaux et alliages – série galvanique – en fonction de la valeur du potentiel dans un milieu donné.
Ce sont les paramètres environnementaux comme les concentrations en agents agressifs qui déterminent la vitesse de corrosion.
Pour qu’il y ait corrosion il faut de l’eau. S’il y a de l’eau, quelle que soit sa Qualité, il y a corrosion. Les vitesses de corrosion peuvent varier de quelques microns à plus de 7cm par an …
ISO 9226 Corrosion des métaux et alliages — Corrosivité des atmosphères — Détermination de la vitesse de corrosion d’éprouvettes de référence pour l’évaluation de la corrosivité.
Cette norme spécifie les méthodes utilisables pour déterminer la vitesse de corrosion d’éprouvettes de référence. Les valeurs obtenues par mesurage (vitesses de corrosion pour la première année d’exposition) sont destinées à servir de critères de classification pour l’évaluation de la corrosivité des atmosphères conformément à l’ISO 9223. Elles peuvent également servir pour l’évaluation informative de la corrosivité atmosphérique ne relevant pas du domaine d’application de l’ISO 9223.
ISO 9223 Corrosion des métaux et alliages — Corrosivité des atmosphères — Classification, détermination et estimation.
Cette norme définit des classes de corrosivité des environnements atmosphériques en fonction de la vitesse de corrosion d’éprouvettes de référence sur la première année, donne des fonctions dose-réponse pour l’estimation normative de la classe de corrosivité sur la base de la perte par corrosion sur la première année calculée sur des métaux de référence, et rend possible une estimation informative de la classe de corrosivité fondée sur la connaissance de la situation environnementale locale.
Elle spécifie les facteurs clés de la corrosion atmosphérique des métaux et alliages. Ces facteurs sont la relation température-humidité, la pollution par le dioxyde de soufre et les sels contenus dans l’air.
Elle ne caractérise pas la corrosivité d’atmosphères de service spécifiques, telles que les atmosphères des industries chimiques ou métallurgiques.
L’ISO 8044 définit les termes relatifs à la corrosion qui sont largement employés dans les sciences et techniques modernes. Certaines définitions sont complétées par de brèves explications.